Peptiden spelen een essentiële rol in fundamentele fysiologische processen en zijn noodzakelijk voor veel biochemische processen. Een peptide is een korte reeks van 2 tot 50 aminozuren, gevormd door een condensatiereactie, die samenkomen via een covalente binding.[1] Opeenvolgende covalente bindingen met extra aminozuren vormen een peptideketen en het bouwsteen van eiwitten.
Peptiden worden genoemd op basis van het aantal aminozuurresiduen in de sequentie. Naarmate peptideketens zich vormen door het samenvoegen van de primaire structuur van aminozuren, kunnen ze groter worden en een oligopeptide worden wanneer er tussen de 10 en 20 aminozuren in de keten zitten. In vivo wordt elk aminozuur toegevoegd aan het aminoterminal van één aminozuur om een peptideketen te vormen.[1] Wanneer er meer dan 20 aminozuren zijn, is het peptide een onvertakte keten, aangeduid als een polypeptide.
Elk aminozuur dat deel uitmaakt van een peptide wordt een "residu" genoemd, omdat dat het deel is dat overblijft na het verlies van water in de dehydratiereactie. Aminozuren zijn de organische startmoleculen bestaande uit een carboxyl-terminaal en een aminogroep die de basis vormen van een eiwit. Peptidesynthese is afhankelijk van drie hoofdreacties: 1. een aminozuur ondergaat een deprotectiestap, een voorbereidende reactie die het volgende aminozuur aan de keten toevoegt, en tot slot, een koppelingsreactie die het uiteindelijke peptide met functionaliteit vormt.[1] In de tweede stap wordt het aminozuur geactiveerd met verschillende reagentia. De carboxylgroep in het aminozuur reageert om de geactiveerde vorm te maken, die vervolgens deelneemt aan een koppelingsreactie. Na één ronde van peptidesynthese is dit proces herhaalbaar om meer aminozuren toe te voegen totdat de gewenste lengte van het peptide is bereikt.
Peptidebindingen zijn bestand tegen omstandigheden die eiwitten denatureren, zoals hoge temperaturen en een hoge concentratie ureum. Aminozuren hebben allemaal dezelfde algemene structuur, met een positieve lading op stikstof en een negatieve lading op de carbonylgroep.[1]
Fundamenten
Peptidebindingen
De peptidebinding gevormd in de actieve site van het ribosoom heeft een gedeeltelijk dubbele-bond karakter.[2] Deze binding is meer rigide en vlak dan een enkele binding, omdat dubbele bindingen korter en sterker zijn en meer vrije energie vereisen om ze te verbreken. Vanwege de sterische interferentie van R-groepen is de binding bijna altijd een trans-binding.[2] De aard van de binding voorkomt volledige vrije rotatie tussen het carbonylkoolstof en de stikstof van de peptidebinding. De bindingen tussen de andere koolstofatomen kunnen echter vrij roteren. Deze configuratie staat toe dat er meerdere configuraties en isomeren van peptiden worden gecreëerd.
Bioactieve Peptiden
Terwijl aminozuren samenkomen om een peptide te vormen, kunnen specifieke bioactieve peptiden worden ontworpen met implicaties voor de farmaceutische industrie en het gebruik van biologisch ontwerp voor therapeutisch biomedisch onderzoek.[3] Uitgebreid onderzoek heeft de veelzijdige rol van bioactieve peptiden aangetoond, met effectiviteit op het gebied van bloeddrukverlaging, antimicrobiële eigenschappen, ontstekingsremmende werking, antitrombotische werking, verbeterde respons op infectie en antioxidante eigenschappen.[4] De fundamentele aard van peptiden als de bouwstenen van eiwitten staat toe dat deze endogene stoffen synthetisch worden nagemaakt en in vitro worden nagebootst om specifieke cellulaire functies te reguleren en een ontelbaar aantal biochemische processen in het lichaam te vergemakkelijken.
Cellulair Niveau
Het proces van biochemische synthese van een peptide van zijn primaire aminozuurstructuur tot een uiteindelijke eiwitstructuur is een fundamenteel biologisch proces. Dit gedeelte geeft een overzicht van de mechanismen die betrokken zijn bij het synthetiseren van een peptidesequentie en belicht belangrijke cellulaire locaties en specifieke enzymen.
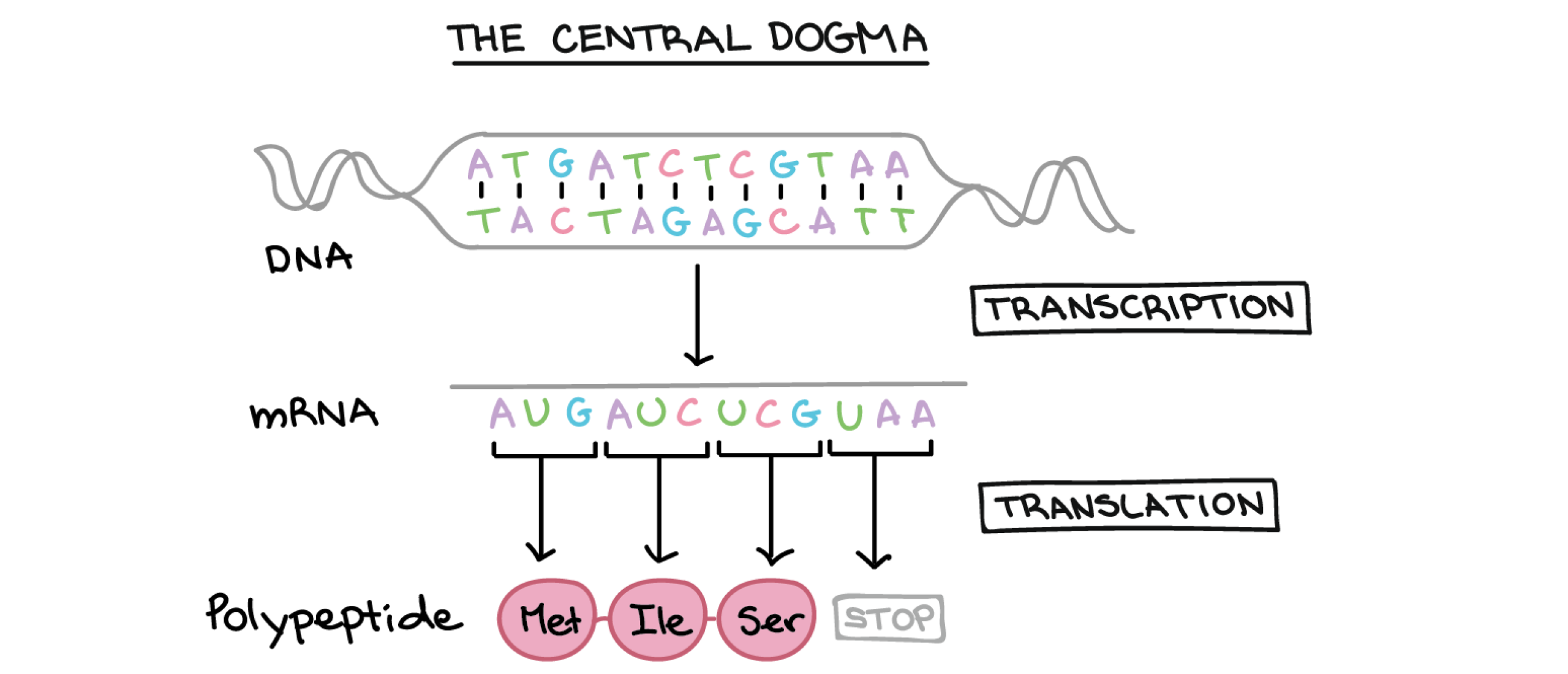
Biologisch actieve peptiden, waaronder neurotransmitters en hormonen, worden gecreëerd vanuit een RNA-template, getranscribeerd vanuit DNA.[1] Eerst vertaalt een ribosoom een signaalsequentie die het aan een signaalherkenningsdeeltje (SRP) aan het ruwe endoplasmatisch reticulum (RER) koppelt. In vivo, na de overgang van de kern naar het cytoplasma naar de bevestiging van een ribosoom, zal mRNA het proces van translatie en de vorming van de peptideketen beginnen.
De stappen van translatie verdelen zich in initiatie, elongatie en terminatie.[1] De initiatiestap omvat een mRNA dat bindt aan een klein subeenheid van het ribosoom.[2] Een groep vergelijkbare nucleotidesequenties, de zogenaamde Kozak-sequenties, omringen het startcodon; ze fungeren als een herkenningspunt voor de kleine subeenheid van het ribosoom om het startcodon, AUG, dat codeert voor methionine, te herkennen en eraan te hechten, gebonden aan het anticodon van tRNA. De grote subeenheid heeft een A-, P- en E-site, en de eerste stap is de binding van de kleine subeenheid in de P-site.[5] Naarmate elk aminozuur aan zijn overeenkomstige tRNA hecht met behulp van ATP, katalyseert het enzym aminoacyl-tRNA-synthetase de binding.[5] Telkens wanneer een peptidebinding ontstaat, waarbij twee aminozuren aan elkaar worden gekoppeld, treedt een condensatiereactie op met verlies van een watermolecuul.[1]
Met de uitbreiding en toevoeging van extra aminozuren wordt vervolgens een polypeptide gecreëerd en voorbestemd om de belangrijkste macromolecuulcomponent van cellen te worden, namelijk eiwit. Posttranslationele modificatie van peptiden, zoals methylering, fosforylering, acetylering, kan ook de snelheid van peptidesynthese veranderen.[6]
Naarmate een groeiend peptide zich vormt, wordt het vervolgens afgesplitst van zijn signaalsequentie, waardoor een groot preprohormoon ontstaat, dat vervolgens verder wordt gesplitst in een prohormoon. Als prohormoon wordt het verpakt in vesikels en naar het Golgi-apparaat gestuurd voor verdere verwerking en om proteolytisch te worden gesplitst in hun uiteindelijke vorm. Het uiteindelijke peptide wordt verpakt in secretorische vesikels en verlaat de cel via exocytose wanneer ze een stimulus ontvangen.
De vastgestelde methode in een laboratoriumomgeving voor de productie van het synthetische peptide staat bekend als solid-phase peptide synthesis (SPPS).[7] Dit proces maakt de snelle assemblage van een peptideketen mogelijk door een reeks opeenvolgende reacties van aminozuurderivaten in een reeks koppelings- en deprotectietechnieken.[7][8]
Moleculair Niveau
Peptide Hormonen
Peptidehormonen zijn in water oplosbare moleculen die variëren in lengte en vorm, en die bestaan uit 3 tot 200 aminozuren die verbonden zijn door peptidebindingen. Peptidehormonen worden lokaal gesynthetiseerd en kunnen naar afgelegen weefsels reizen met implicaties voor fysiologische groei en differentiatie. De paracriene en mogelijk autocrine werking van deze peptidehormonen draagt bij aan de groei, overleving en functionaliteit van de weefsels waarop ze inwerken.[9] Deze hormonen variëren breed in grootte, structuur en functie. Het volgende is slechts een beknopte lijst en vertegenwoordigt niet alle fysiologische en endogene peptidehormonen in het lichaam; desalniettemin zijn deze peptidefamilies opmerkelijk.
De Pro-opiomelanocortin (POMC) genfamilie is oorspronkelijk een 241 aminozuurresidu dat wordt gekliefd op verschillende lysineresiduen door proteolyse om unieke, actieve peptiden te creëren. De gecreëerde peptiden omvatten melanocyt-stimulerende factor (MSH), adrenocorticotroop releasing hormoon (ACTH), B-lipotropine en B-endorfine, en worden tot expressie gebracht in perifere weefsels en de hersenen.[10]
Oxytocine en ADH De achterste hypofyse produceert twee peptidehormonen die slechts twee aminozuren verschillen: oxytocine en anti-diuretisch hormoon (ADH). Zowel oxytocine als ADH zijn nonapeptiden met een disulfidebrug.[11] Deze nonapeptiden worden verpakt via een proces met dragereiwitten die neurofysines worden genoemd.[12]
Insuline is een 51 aminozuur peptidehormoon dat bestaat uit twee disulfide-verbonden peptideketens.[12] De IGF-1 (insulineachtige groeifactor-1) familie zijn ook peptidehormonen, maar hebben drie disulfidebruggen.[12] De rol van insuline in het lichaam is veelzijdig en omvat het reguleren van metabole homeostase, inclusief opname van glucose uit het bloed en opslag van glucose als glycogeen in de lever.
Glucagon wordt gemaakt wanneer proglucagon wordt gesplitst door prohormoonconverter 2, om een volledig verwerkt bioactief peptide te vormen.[13] Het wordt afgegeven door alfacellen in de alvleesklier als reactie op hypoglykemie of zelfs tijdens een homeostatische toename van concentraties van aminozuren.[13] De effecten van glucagon om homeostatische evenwicht in het hele lichaam te bevorderen, werken via mechanismen die de energie-uitgaven en glucosemetabolisme in evenwicht brengen. De studie van dit peptidehormoon en zijn mechanismen biedt een basis voor het begrip van therapieën voor diabetesmanagement en andere aandoeningen.[13]
Secretine is een ander voorbeeld van een peptidehormoon, met een N-terminaal en C-terminaal uiteinde, samengesteld uit een 27 aminozuren tellende sequentie.[14] Dit peptide komt voort uit het SCT-gen en wordt eerst een prohormoon dat bekend staat als prosecretine. Eenmaal geactiveerd door blootstelling aan maagzuur, wordt het gesplitst in de actieve peptidevorm en afgegeven door S-cellen in het slijmvlies van de twaalfvingerige darm.[14] Het fungeert om de alvleesklier en galwegen te stimuleren om bicarbonaat vrij te geven, wat dient om potentieel schadelijke maagzuren die de maag binnenkomen, te neutraliseren.[15]
Calcitonine-gen-gerelateerd peptide (CGRP) is een 37-aminozuur neuropeptide, dat meestal gelokaliseerd is in C- en Aδ-sensorvezels, maar invloed heeft op zowel het centrale als perifere zenuwstelsel en metabolisme via een veelvoud aan receptortypen.[16] Nieuw onderzoek heeft aangetoond dat intraperitoneale behandeling met CGRP een stimulerend effect op energie kan hebben en zelfs een verhoogde eetlust kan bevorderen.[17] Huidig onderzoek heeft ook de activiteit van CGRP in het cerebrovasculaire systeem gekoppeld aan een mogelijke etiologie van migraineaanvallen.[18] CGRP wordt voornamelijk gevonden in het enterische zenuwstelsel, maar wordt verondersteld een potentiële rol te spelen in craniale nociceptie en cerebrale vasodilatatie, wat leidt tot ernstige migraine-hoofdpijn.[19]
Natriuretische peptiden zijn kleine peptidehormonen die worden uitgescheiden door hartmyocyten als reactie op spanning of wandstress.[20] Dit peptidesysteem, waaronder atriaal natriuretisch peptide (ANP), hersennatriuretisch peptide (BNP) en C-type natriuretisch peptide (CNP), wordt allemaal uitgescheiden door het hartatrium als beschermingsmechanismen om ongunstige cardiovasculaire/renale aandoeningen te voorkomen, waaronder antiproliferatieve, antiremodellerende, vaatverwijdende en modulatie van het renine-angiotensine-aldosteronsysteem.[20] Het peptide, ANP, wordt uitgescheiden in het atrium van het hartweefsel en is bekend 28 aminozuren te zijn die door disulfidebruggen zijn verbonden.[20] BNP daarentegen deelt 17 gemeenschappelijke aminozuren met ANP, maar is een 32 aminozuur peptide, terwijl CNP in totaal 22 aminozuren lang is.[20] Isolatie en begrip van deze peptidehormonen hebben een beter begrip opgeleverd van fysiologische bloeddrukregeling en de mogelijkheid van natriuretische peptiden voor therapeutische doeleinden.[21]
Pathofysiologie
Pathofysiologische processen gerelateerd aan peptiden zijn zeer breed vanwege de alomtegenwoordige aanwezigheid van peptiden in het lichaam. In dit gedeelte wordt beschreven hoe peptiden betrokken zijn bij de pathofysiologie van verschillende metabolische processen.
Peptide-Receptor Complex en Signaleringscascade
Biologisch actieve peptiden worden geproduceerd uit genen die zich richten op specifieke eiwitten of eiwit-gekoppelde receptoren, zoals G-eiwit-gekoppelde receptoren (GPCR's).[22] De combinatie van dit peptide-receptorcomplex kan vervolgens een reeks cascaderende reacties aan- of uitschakelen via een veelheid aan mechanismen. Deze geactiveerde neerwaartse reacties kunnen andere G-eiwitten, tyrosinekinases en een reeks transcriptiegebeurtenissen omvatten en zo alle cellulaire verwerking en functies regelen.[22]
In sommige gevallen, wanneer een peptide aan een receptor bindt en een pathologische "aan"-staat veroorzaakt, kunnen ongereguleerde transcriptie en proliferatie optreden, wat leidt tot een oncologische toestand. Deze cellulaire processen kunnen ongecontroleerd blijven en resulteren in tumorgroei. Het ontwerp van synthetische peptiden, gemaakt om te handelen zoals endogene peptiden en te binden aan een doelreceptor, kan de locatie van tumorgroei identificeren, zelfs voor therapeutische doeleinden.
Infectie
Peptiden spelen een grote endogene rol bij mensen en andere soorten als eerstelijnsbarrière tegen infecties. Een van de componenten van het aangeboren immuunsysteem van het lichaam omvat de productie van antimicrobiële peptiden (AMP's) in het epitheel.[23] Naast het epitheel worden AMP's ook geproduceerd door neutrofielen, mestcellen en zelfs adipocyten [24]. Deze AMP's kunnen post-translationeel worden gemodificeerd om te vechten tegen een breed scala aan verschillende infecties, en met hun kationische aard kunnen ze interageren met het negatief geladen bacteriële oppervlak. Een zeer belangrijke subset van AMP's wordt defensinen en cathelicidinen genoemd.[24]
Dermcidin is een bekend gen dat antimicrobiële resistentiepeptiden codeert in de zweetklieren die kunnen overleven bij een hoge zoutconcentratie en over een breed pH-bereik.[25] Het is bekend dat sommige bacteriën zelfs hun AMP's kunnen produceren en mechanismen voor resistentie ontwikkelen tegen endogene AMP's, zodat ze de peptiden proteolytisch kunnen splitsen en overleven.[24]
Klinische Betekenis
Zoals eerder vermeld, spelen peptiden een essentiële rol in veel fysiologische processen die in het hele lichaam aanwezig zijn. De klinische betekenis van peptiden zal hieronder worden samengevat, inclusief enkele dermatologische ziektebeelden en therapeutisch gebruik van peptiden als beeldvormende sondes met betrekking tot oncologie voor beeldvorming en doelgerichte tumortherapie. Let op dat de verstrekte informatie beknopt is en niet bedoeld is om alle fysiologische processen die peptiden betrekken, te vertegenwoordigen.
Wondgenezing
Endogene peptiden spelen ook een rol bij wondgenezing en inductie van mesenchymale cellen om te differentiëren en bacteriolysis binnen de wond te bevorderen en genezing te vergemakkelijken. Antimicrobiële peptiden vanuit wondvloeistof geïnduceerd door bekende syndecan, een celmembraan-heparansulfaat proteoglycaan.[26] Syndecan activeert heparine-bindende groeifactoren en weefselmatrixstoffen om wondgenezing in beschadigde weefsels te vergemakkelijken.[26]
Chronische inflammatoire huidaandoeningen
Zoals eerder vermeld, kan gezonde huid AMP's afscheiden om zich te verdedigen tegen oppervlakteaanvallen, vooral door gram-positieve en gram-negatieve bacteriën, virussen en schimmels.[27] Het is aangetoond dat peptiden een rol spelen bij een chronisch verstoord epitheelmicrobioom, wat weefsel vatbaar maakt voor pathogene infectie en persistentie van inflammatoire huidaandoeningen.[28] In de ontstoken huid van patiënten met atopische dermatitis in vergelijking met de ontstoken huid van normale proefpersonen is er onderdrukking van antimicrobiële werking door de verminderde expressie van normale epidermale AMP's zoals LL-37, β-defensine-2 en β-defensine-3.[28]
Waar patiënten met atopische dermatitis onderdrukking van AMP's hebben, wat leidt tot een verdere inflammatoire, infectieuze toestand, overexpresseren patiënten met rosacea een antimicrobieel peptide dat bekend staat als cathelicidine-antimicrobieel peptide (CAMP).[27] De metabolieten en producten van dit peptide, CAMP, zijn wat leidt tot de inflammatoire toestand van de epidermis. Kennis van het pad dat CAMP-expressie in epidermaal weefsel stimuleert om antimicrobieel peptidemateriaal te genereren in een anders onderdrukte toestand zoals atopische dermatitis, kan een unieke en nieuwe therapeutische benadering bieden om de inflammatoire toestand van patiënten met deze aandoening te verbeteren.[27]
Moleculaire Beeldvorming en Doelgerichte Tumortherapie
Het mechanisme van endogene peptide- en specifieke receptorbinding is hoofdzakelijk het ontwerp voor peptiden die fungeren als beeldvormende sondes en receptor-bindende peptiden voor overexpressed-receptoren zoals bij kankerproliferatie.[29] Deze sondes kunnen strategisch worden ontworpen in vitro om endogene peptiden na te bootsen die uiteindelijk als biomarkers fungeren en de detectie van een tumor mogelijk maken. De implicaties van deze geavanceerde technologie zijn van toepassing op de specifieke identificatie van tumorgroei en zelfs therapeutische doeleinden. Met de voortschrijdende wetenschappen en moleculaire peptidenchemie en een beter begrip van meer effectieve targeting, hebben deze synthetische peptiden het potentieel om zich te richten op meerdere ziekten met een hoge specificiteit in beeldvormingsmodaliteiten zoals PET/SPECT, optische beeldvorming en MRI.[29]
Naarmate biochemische wetenschappen en therapeutisch ontwerp blijven vorderen, wordt peptide synthese en ontwerp uitgebreid bestudeerd met implicaties voor oncologische therapie, aangezien de farmaceutische industrie zich blijft verplaatsen naar biologische middelen voor nieuwe geneesmiddelkandidaten.[4]
Bronnen
- 1. FRIEDBERG F, WINNICK T, GREENBERG DM. Peptide synthesis in vivo. J Biol Chem. 1947 Aug;169(3):763. [PubMed: 20259112]
- 2. Davidovich C, Belousoff M, Bashan A, Yonath A. The evolving ribosome: from non-coded peptide bond formation to sophisticated translation machinery. Res Microbiol. 2009 Sep;160(7):487-92. [PubMed: 19619641]
- 3. Lovejoy DA, Hogg DW, Dodsworth TL, Jurado FR, Read CC, D'Aquila AL, Barsyte-Lovejoy D. Synthetic Peptides as Therapeutic Agents: Lessons Learned From Evolutionary Ancient Peptides and Their Transit Across Blood-Brain Barriers. Front Endocrinol (Lausanne). 2019;10:730. [PMC free article: PMC6861216] [PubMed: 31781029]
- 4. Saladin PM, Zhang BD, Reichert JM. Current trends in the clinical development of peptide therapeutics. IDrugs. 2009 Dec;12(12):779-84. [PubMed: 19943221]
- 5. Hanson G, Alhusaini N, Morris N, Sweet T, Coller J. Translation elongation and mRNA stability are coupled through the ribosomal A-site. RNA. 2018 Oct;24(10):1377-1389. [PMC free article: PMC6140462] [PubMed: 29997263]
- 6. Kleinkauf H, von Döhren H. Applications of peptide synthetases in the synthesis of peptide analogues. Acta Biochim Pol. 1997;44(4):839-47. [PubMed: 9584867]
- 7. Albericio F, Lloyd-Williams P, Giralt E. Convergent solid-phase peptide synthesis. Methods Enzymol. 1997;289:313-36. [PubMed: 9353728]
- 8. Barany G, Merrifield RB. A chromatographic method for the quantitative analysis of the deprotection of dithiasuccinoyl (Dts) amino acids. Anal Biochem. 1979 May;95(1):160-70. [PubMed: 495950]
- 9. Sanders EJ, Harvey S. Peptide hormones as developmental growth and differentiation factors. Dev Dyn. 2008 Jun;237(6):1537-52. [PubMed: 18498096]
- 10. Harris RM, Dijkstra PD, Hofmann HA. Complex structural and regulatory evolution of the pro-opiomelanocortin gene family. Gen Comp Endocrinol. 2014 Jan 01;195:107-15. [PubMed: 24188887]
- 11. Chan WY. An investigation of the natriuretic, antidiuretic and oxytocic actions of neurohypophysial hormones and related peptides: delineation of separate mechanisms of action and assessment of molecular requirements. J Pharmacol Exp Ther. 1976 Mar;196(3):746-57. [PubMed: 1263121]
- 12. McLaughlin MB, Jialal I. StatPearls [Internet]. StatPearls Publishing; Treasure Island (FL): Jul 17, 2023. Biochemistry, Hormones. [PubMed: 31082156]
- 13. Sandoval DA, D'Alessio DA. Physiology of proglucagon peptides: role of glucagon and GLP-1 in health and disease. Physiol Rev. 2015 Apr;95(2):513-48. [PubMed: 25834231]
- 14. Chey WY, Chang TM. Secretin: historical perspective and current status. Pancreas. 2014 Mar;43(2):162-82. [PubMed: 24518494]
- 15. Brandler J, Miller LJ, Wang XJ, Burton D, Busciglio I, Arndt K, Harmsen WS, Camilleri M. Secretin effects on gastric functions, hormones and symptoms in functional dyspepsia and health: randomized crossover trial. Am J Physiol Gastrointest Liver Physiol. 2020 Apr 01;318(4):G635-G645. [PMC free article: PMC7191464] [PubMed: 32036693]
- 16. Poyner DR. Calcitonin gene-related peptide: multiple actions, multiple receptors. Pharmacol Ther. 1992;56(1):23-51. [PubMed: 1338400]
- 17. Sanford D, Luong L, Gabalski A, Oh S, Vu JP, Pisegna JR, Germano P. An Intraperitoneal Treatment with Calcitonin Gene-Related Peptide (CGRP) Regulates Appetite, Energy Intake/Expenditure, and Metabolism. J Mol Neurosci. 2019 Jan;67(1):28-37. [PMC free article: PMC6736536] [PubMed: 30535790]
- 18. Dubowchik GM, Conway CM, Xin AW. Blocking the CGRP Pathway for Acute and Preventive Treatment of Migraine: The Evolution of Success. J Med Chem. 2020 Jul 09;63(13):6600-6623. [PubMed: 32058712]
- 19. Deen M, Correnti E, Kamm K, Kelderman T, Papetti L, Rubio-Beltrán E, Vigneri S, Edvinsson L, Maassen Van Den Brink A., European Headache Federation School of Advanced Studies (EHF-SAS). Blocking CGRP in migraine patients - a review of pros and cons. J Headache Pain. 2017 Sep 25;18(1):96. [PMC free article: PMC5612904] [PubMed: 28948500]
- 20. Chopra S, Cherian D, Verghese PP, Jacob JJ. Physiology and clinical significance of natriuretic hormones. Indian J Endocrinol Metab. 2013 Jan;17(1):83-90. [PMC free article: PMC3659912] [PubMed: 23776857]
- 21. Rubattu S, Volpe M. Natriuretic Peptides in the Cardiovascular System: Multifaceted Roles in Physiology, Pathology and Therapeutics. Int J Mol Sci. 2019 Aug 16;20(16) [PMC free article: PMC6721730] [PubMed: 31426320]
- 22. Foster SR, Hauser AS, Vedel L, Strachan RT, Huang XP, Gavin AC, Shah SD, Nayak AP, Haugaard-Kedström LM, Penn RB, Roth BL, Bräuner-Osborne H, Gloriam DE. Discovery of Human Signaling Systems: Pairing Peptides to G Protein-Coupled Receptors. Cell. 2019 Oct 31;179(4):895-908.e21. [PMC free article: PMC6838683] [PubMed: 31675498]
- 23. Radaic A, de Jesus MB, Kapila YL. Bacterial anti-microbial peptides and nano-sized drug delivery systems: The state of the art toward improved bacteriocins. J Control Release. 2020 May 10;321:100-118. [PubMed: 32035192]
- 24. Cole JN, Nizet V. Bacterial Evasion of Host Antimicrobial Peptide Defenses. Microbiol Spectr. 2016 Feb;4(1) [PMC free article: PMC4804471] [PubMed: 26999396]
- 25. Schittek B, Hipfel R, Sauer B, Bauer J, Kalbacher H, Stevanovic S, Schirle M, Schroeder K, Blin N, Meier F, Rassner G, Garbe C. Dermcidin: a novel human antibiotic peptide secreted by sweat glands. Nat Immunol. 2001 Dec;2(12):1133-7. [PubMed: 11694882]
- 26. Gallo RL, Ono M, Povsic T, Page C, Eriksson E, Klagsbrun M, Bernfield M. Syndecans, cell surface heparan sulfate proteoglycans, are induced by a proline-rich antimicrobial peptide from wounds. Proc Natl Acad Sci U S A. 1994 Nov 08;91(23):11035-9. [PMC free article: PMC45161] [PubMed: 7972004]
- 27. Park K, Lee S, Lee YM. Sphingolipids and antimicrobial peptides: function and roles in atopic dermatitis. Biomol Ther (Seoul). 2013 Jul 30;21(4):251-7. [PMC free article: PMC3819896] [PubMed: 24244808]
- 28. Marcinkiewicz M, Majewski S. The role of antimicrobial peptides in chronic inflammatory skin diseases. Postepy Dermatol Alergol. 2016 Feb;33(1):6-12. [PMC free article: PMC4793058] [PubMed: 26985172]
- 29. Lee S, Xie J, Chen X. Peptide-based probes for targeted molecular imaging. Biochemistry. 2010 Feb 23;49(7):1364-76. [PMC free article: PMC2829605] [PubMed: 20102226]