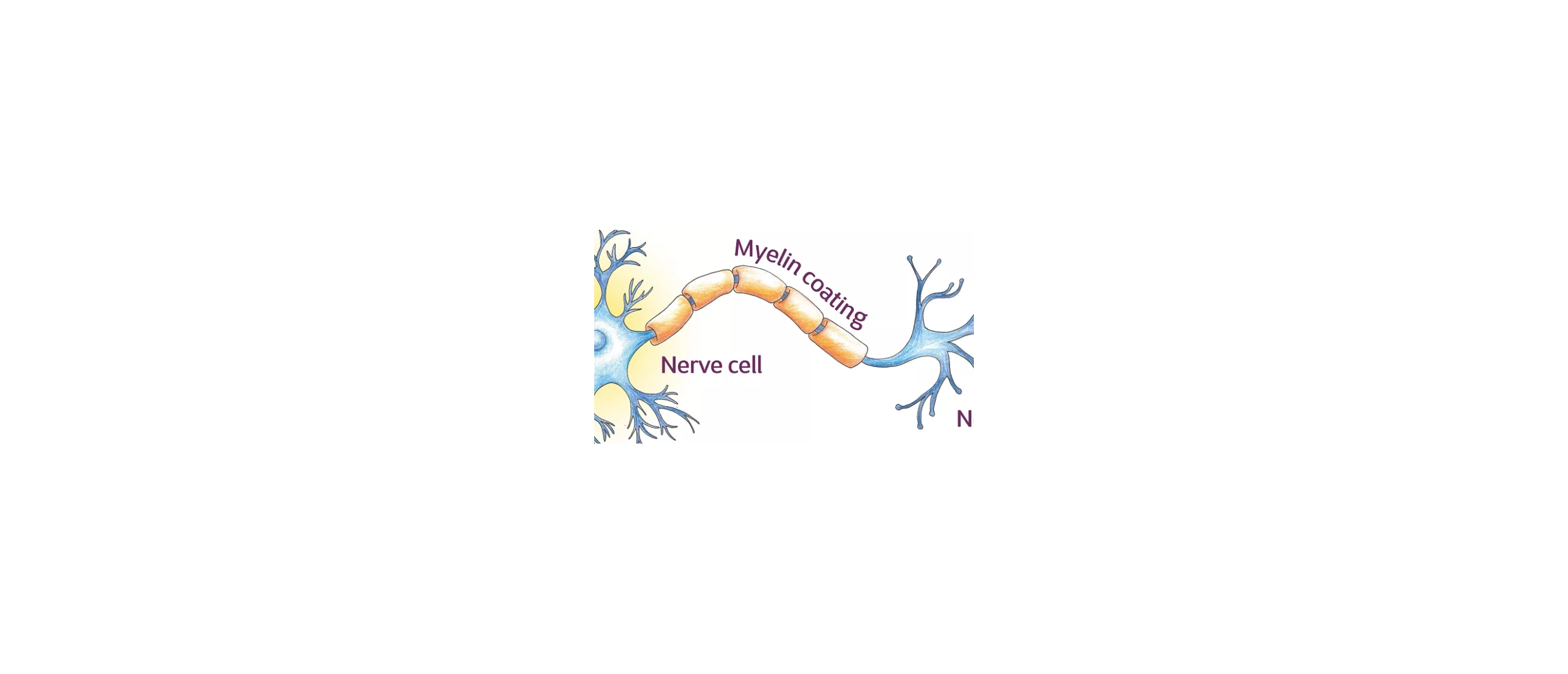
De myelineschede is een sterk uitgebreide en gemodificeerde plasmamembraan die op een spiraalvormige manier om de zenuwaxon is gewikkeld [1]. De myelinemembranen komen voort uit en maken deel uit van de Schwann-cellen in het perifere zenuwstelsel (PNS) en de oligodendrogliale cellen in het centrale zenuwstelsel (CNS). Elke myeline-genererende cel levert myeline voor slechts één segment van een gegeven axon. De periodieke onderbrekingen waar korte delen van de axon niet bedekt zijn door myeline, zijn de knopen van Ranvier, en ze zijn cruciaal voor de werking van myeline.
Myeline vergemakkelijkt geleiding
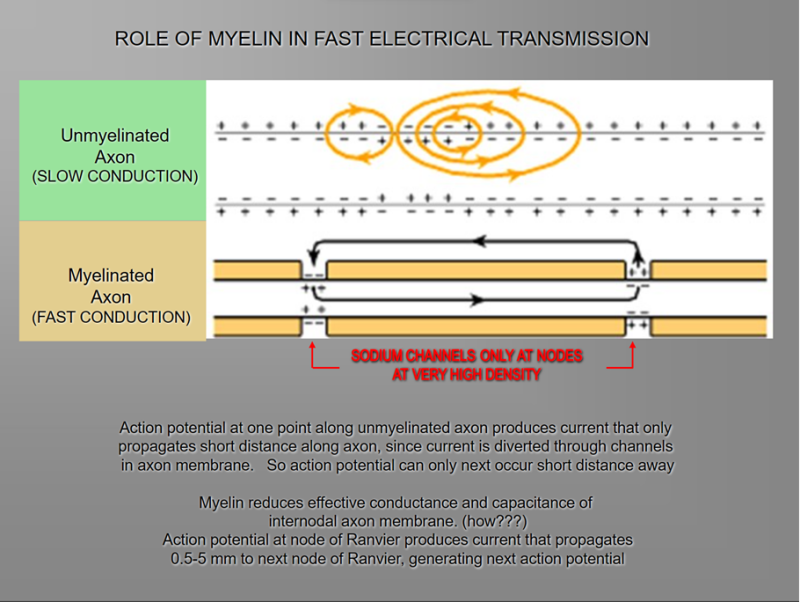
Myeline is een elektrische isolator; echter, de functie om de geleiding in axonen te vergemakkelijken heeft geen exacte analogie in elektrische schakelingen. Bij onmyeliniseerde vezels wordt impulsgeleiding voortgebracht door lokale circuits van ionenstroom die naar het actieve gebied van het axonmembraan stromen, door het axon gaan en door aangrenzende secties van het membraan naar buiten gaan (Fig. 4-1). Deze lokale circuits depolariseren het aangrenzende stuk membraan op een continue, opeenvolgende manier. In myeliniseerde axonen wordt het prikkelbare axonmembraan alleen blootgesteld aan de extracellulaire ruimte op de knopen van Ranvier; dit is de locatie van natriumkanalen [2]. Wanneer het membraan bij de knoop wordt geprikkeld, kan het lokale circuit dat wordt gegenereerd niet door de hoge weerstand van de schede stromen en stroomt daarom door en depolariseert het membraan bij de volgende knoop, die mogelijk 1 mm of verder weg is (Fig. 4-1). De lage capaciteit van de schede betekent dat er weinig energie nodig is om de resterende membranen tussen de knopen te depolariseren, wat resulteert in lokale circuitverspreiding met verhoogde snelheid. Actieve opwinding van het axonmembraan springt van knooppunt naar knooppunt; deze vorm van impulsvoortplanting wordt saltatoire geleiding genoemd (Latijn saltare, "springen"). Deze beweging van de depolarisatiegolf is veel sneller dan in ongemyeliniseerde vezels. Bovendien, omdat alleen de knopen van Ranvier worden opgewonden tijdens de geleiding in myeliniseerde vezels, is de Na+-flux naar de zenuw veel minder dan in ongemyeliniseerde vezels, waar het hele membraan betrokken is. Een voorbeeld van het voordeel van myelinisatie wordt verkregen door vergelijking van twee verschillende zenuwvezels, beide met een geleidingssnelheid van 25 m/seconde bij 20°C. De ongemyeliniseerde reuzenaxon van de inktvis met een diameter van 500 mm vereist 5000 keer zoveel energie en neemt ongeveer 1500 keer zoveel ruimte in als de myeliniseerde zenuw met een diameter van 12 mm bij de kikker.
Afbeelding 4-1
Impulsgeleiding in ongemyeliniseerde (boven) en myeliniseerde (onder) vezels. Pijlen tonen de stroom van actiepotenties in lokale circuits naar het actieve gebied van het membraan. In ongemyeliniseerde vezels stromen de circuits door het aangrenzende stuk membraan, (meer...)
Myelin Limits Axonal Diameter
Geleidingssnelheid in myeliniseerde vezels is evenredig met de diameter, terwijl deze in ongemyeliniseerde vezels evenredig is met de vierkantswortel van de diameter. Daarom worden verschillen in energie- en ruimtevereisten tussen de twee soorten vezels overdreven bij hogere geleidingssnelheden. Als zenuwen niet-gemyeliniseerd waren en equivalentie geleidingssnelheden werden gehandhaafd, zou het ruggenmerg van de mens zo groot moeten zijn als een forse boomstam. Myeline vergemakkelijkt dus de geleiding terwijl het ruimte en energie conserveert [3].
Myeline heeft een karakteristieke ultrastructuur
Myeline, evenals veel van zijn morfologische kenmerken, zoals de knopen van Ranvier en Schmidt-Lantermann-spleten, kan gemakkelijk worden waargenomen met lichtmicroscopie (Afbeelding 4-2). Verdere inzichten komen uit biofysische studies van structuren met parallelle axonen: de nervus ischiadicus als vertegenwoordiger van het PNS en de oogzenuw of baan als vertegenwoordiger van het CNS. Myeline vertoont bij onderzoek met gepolariseerd licht zowel een lipideafhankelijke als een eiwitafhankelijke birefringentie. Röntgendiffractiestudies met een lage hoek van myeline leveren elektronendichtheidsplots van de herhalende eenheid die drie pieken laten zien die overeenkomen met eiwit plus lipide polaire groepen en twee troggen die overeenkomen met lipide koolwaterstofketens. De herhaalde afstand varieert enigszins afhankelijk van de soort en of het monster afkomstig is van het CNS of het PNS. De resultaten van deze twee technieken zijn dus consistent met een eiwit-lipide-eiwit-lipide-eiwitstructuur, waarbij het lipidengedeelte een bimoleculaire bladzijde is en aangrenzende eiwitlagen op de een of andere manier verschillend zijn. Gegevens voor de zoogdierenoogzenuw tonen een herhalingsafstand van 80 Å (Afbeelding 4-3). Deze ruimte kan één bimoleculaire laag lipide bevatten (ongeveer 50 Å) en twee eiwitlagen (ongeveer 15 Å per stuk). De belangrijkste herhalingsenheid van twee van dergelijke versmolten eenheidsmembranen is tweemaal dit cijfer, of 160 Å [5]. Hoewel het nuttig is om te denken aan myeline in termen van afwisselende eiwit- en lipidelagen, is dit concept enigszins aangepast om compatibel te zijn met het “fluid mosaic” model van membraanstructuur, dat intrinsieke transmembraaneiwitten en extrinsieke eiwitten omvat.

Afbeelding 4-2
Lichtmicroscopie van een 1-μm Epon-snede van perifere zenuw van konijn (voorste wortel) gekleurd met toluidineblauw. De myelineschede verschijnt als een dikke zwarte ring rond de bleke axon. ×600, voor 30% reductie. (Met dank aan dr. Cedric Raine.) (meer...)
Afbeelding 4-3
Een samengesteld diagram waarin enkele van de ultrastructurele gegevens over CNS-myeline worden samengevat. Bovenin wordt een oligodendrogliale cel getoond die verbonden is met de schede door een proces. Het doorgelichte beeld van de myeline en de axon illustreert de relatie tussen deze twee structuren (meer...)
Informatie over de structuur van myeline is ook beschikbaar via elektronenmicroscopische studies, die myeline visualiseren als een reeks eiwitlagen die verschijnen als afwisselend donkere en minder donkere lijnen gescheiden door lipide koolwaterstofketens die verschijnen als ongekleurde zones (Figs. 4-4–4-7). Er is asymmetrie in het kleuren van de eiwitlagen. De minder donkere, of intraperiode, lijn vertegenwoordigt de nauw aansluitende buitenste eiwitmantels van het oorspronkelijke celmembraan; de membranen zijn feitelijk niet versmolten omdat ze op hoge resolutie als een dubbele lijn kunnen worden opgelost (Figs. 4-6 en 4-7). De donkere, of belangrijkste periode, lijn is de versmolten, binnenste eiwitmantel van het celmembraan. De herhaalde afstanden waargenomen met elektronenmicroscopie zijn minder dan die berekend uit de gegevens van röntgendiffractie met lage hoek, als gevolg van de aanzienlijke krimp die plaatsvindt na fixatie en dehydratatie. Het verschil in periodiciteit tussen PNS en CNS myeline wordt echter gehandhaafd; perifeer myeline heeft een gemiddelde herhalingsafstand van 119 Å en centraal myeline, 107 Å.
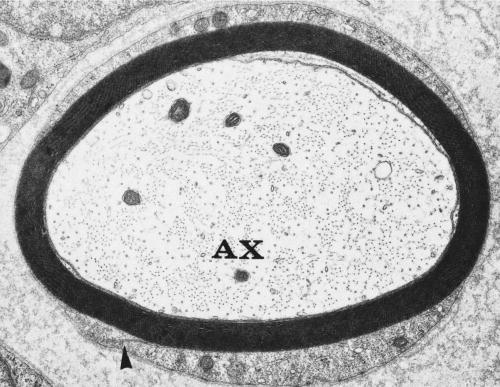
Afbeelding 4-4
Elektronenmicroscopie van een enkele perifere zenuwvezel van konijn. Let op dat de myelineschede een lamellaire structuur heeft en wordt omringd door cytoplasma van Schwann-cellen. De buitenste mesaxon (pijlpunt) is te zien linksonder. AX, axon. ×18.000. (meer...)
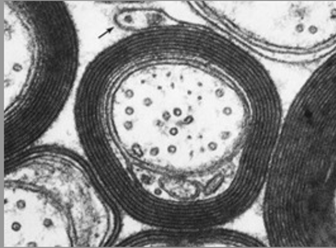
Afbeelding 4-7
Een typische gemyeliniseerde vezel van het CZS van een volwassen hond. Vergelijk deze figuur met de PNS-vezel in Figuur 4-3. De loop van het afgeplatte oligodendrocytische proces, beginnend bij de buitenste tong (pijl), kan worden gevolgd. Merk op dat de vezel (meer...)

Afbeelding 4-6
Vergroting van de myelineschede van Figuur 4-4. Let op dat de intraperiod-lijn (pijlen) bij deze hoge resolutie een dubbele structuur heeft. ×350.000. (Met dank aan Dr. Cedric Raine.)
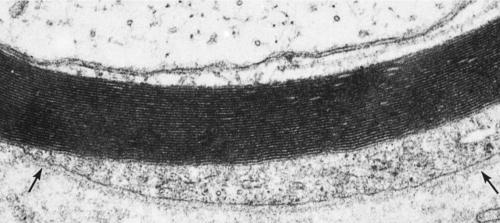
Afbeelding 4-5
Hogere vergroting van Figuur 4-4 om het cytoplasma van de Schwann-cel te laten zien, bedekt met basale lamina (pijlen). ×50,000.
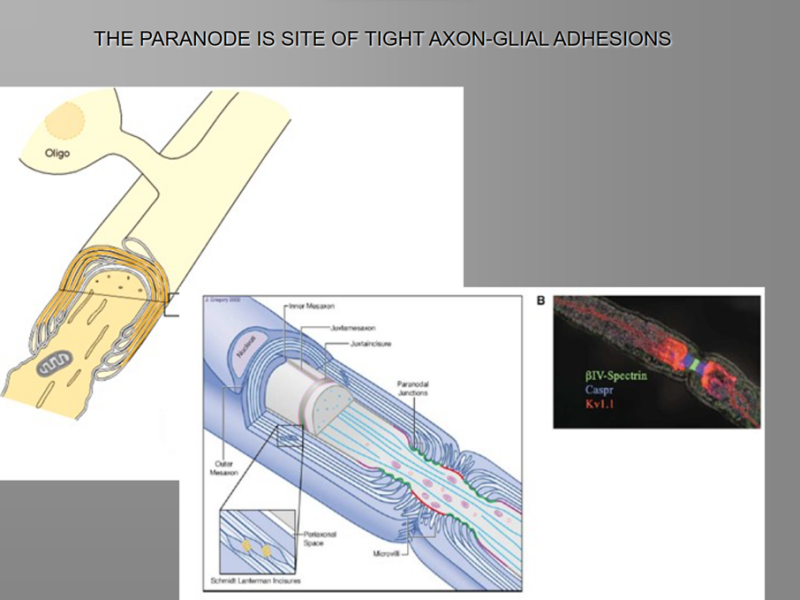
Nodes of Ranvier. Twee aangrenzende segmenten myeline aan één axon worden gescheiden door een node of Ranvier. In dit gebied is het axon niet bedekt met myeline. In het paranodale gebied en de Schmidt-Lantermann-clefts zijn de cytoplasmatische oppervlakken van myeline niet samengeperst en is het cytoplasma van Schwann- of gliacellen opgenomen binnen de schede. Om deze structuren te visualiseren, kan men verwijzen naar Figuur 4-8 en 4-9, die laten zien dat als myeline zou worden uitgerold vanaf het axon, het een plat, spadevormig vel zou zijn omgeven door een buis van cytoplasma. Dus, zoals te zien is in elektronenmicroscopische beelden van longitudinale secties van axon paranodale gebieden, opent de door aanraking van de cytoplasmatische oppervlakken gevormde grote dichte lijn zich aan de randen van het vel, waarbij cytoplasma wordt ingesloten in een lus (zie Figuur 4-3 en 4-9). Deze lusvormige uiteinden van de schede bij de node worden laterale lussen genoemd. De lussen vormen membraancomplexen met de axolemma genaamd transversale banden, terwijl myeline in het internodale gebied is gescheiden van het axon door een kloof van periaxonaal ruimte.
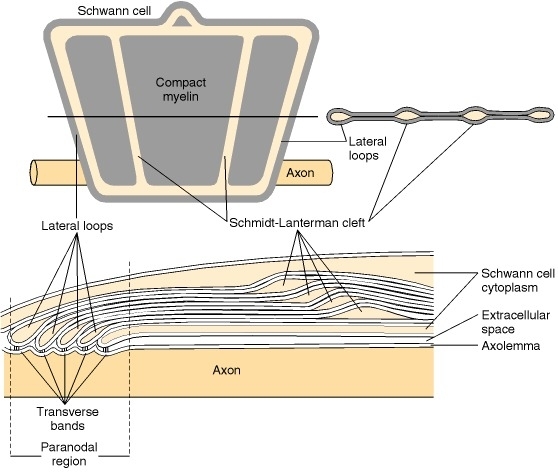
Figuur 4-8
Een diagram dat het uiterlijk van CNS-myeline laat zien als het van het axon zou worden uitgerold. Men kan zich voorstellen dat deze structuur ontstaat uit Figuur 4-3 als het gliacelproces recht omhoog wordt getrokken en de myelinelagen worden gescheiden bij de tussenliggende periode lijn. (meer...)
Een diagram vergelijkbaar met Figuur 4-8 maar met één Schwann-cel en zijn myelineschede uitgerold vanaf een perifeer axon. Het vel van PNS-myeline is, net als CNS-myeline, omgeven door een buis van cytoplasma en heeft extra buizen van cytoplasma, die de (meer...)
Schmidt-Lantermann-clefts zijn structuren waar de cytoplasmatische oppervlakken van de myelineschede niet zijn samengeperst tot de grote dichte lijn en in plaats daarvan cytoplasma van Schwann- of gliacellen bevatten (Figuur 4-9). Deze regio's komen veel voor in perifere gemyeliniseerde axonen maar zijn zeldzaam in het CZS. Deze insluitsels van cytoplasma zijn aanwezig in elke laag myeline. De spleten kunnen worden gevisualiseerd in het uitgerolde myelinevel als buizen van cytoplasma vergelijkbaar met de buizen die de laterale lussen vormen, maar dan in het midden van het vel, in plaats van aan de randen (Figuur 4-9).
Myeline is een uitbreiding van een celmembraan
In het PNS wordt myelinisatie voorafgegaan door de invasie van de zenuwbundel door Schwann-cellen, snelle vermenigvuldiging van deze cellen en afscheiding van de individuele axonen door processen van Schwann-cellen. Kleinere axonen (≤1 μm), die ongemyeliniseerd zullen blijven, worden gescheiden; er kunnen er meerdere worden ingesloten in één cel, elk binnen zijn eigen zak, vergelijkbaar met de structuur getoond in Figuur 4-10A. Grote axonen (≥1 μm) die bestemd zijn voor myelinisatie worden afzonderlijk ingesloten, één cel per axon per internode. Deze cellen stellen zich op langs de axonen met tussenpozen ertussen; de tussenpozen worden de nodes van Ranvier.
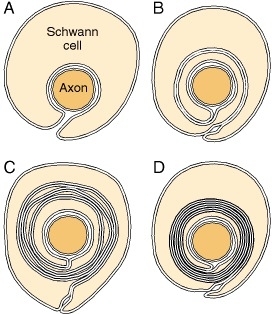
Figuur 4-10
Myelinvorming in het perifere zenuwstelsel. A: De Schwann-cel heeft het axon omringd, maar de externe oppervlakken van het plasmamembraan zijn nog niet versmolten in de mesaxon. B: De mesaxon is versmolten tot een vijflagige structuur en heeft zich één keer gespiraliseerd (meer...)
Voor myelinisatie ligt het axon in een invaginatie van de Schwann-cel (Figuur 4-10A). Het plasmalemma van de cel omringt vervolgens het axon en sluit zich aan om een dubbelmembraanstructuur te vormen die communiceert met het celoppervlak. Deze structuur, de mesaxon, strekt zich uit rond het axon in een spiraalvorm (Figuur 4-10). Zo lijkt de topologische formatie van myeline op het oprollen van een slaapzak; de mesaxon wikkelt zich om het axon, en de cytoplasmatische oppervlakken condenseren tot een compacte myelineschede en vormen de grote dichte lijn. De twee externe oppervlakken vormen de intraperiodlijn van myeline.
In het CZS worden de structuren van myeline gevormd door de oligodendrogliale cel [7]. Dit heeft veel overeenkomsten, maar ook verschillen met betrekking tot myelinisatie in het PNS. CZS zenuwvezels worden niet gescheiden door bindweefsel, noch worden ze omgeven door celcytoplasma, en specifieke gliakernen zijn niet duidelijk geassocieerd met bepaalde gemyeliniseerde vezels. CZS-myeline is een spiraalvormige structuur vergelijkbaar met PNS-myeline; het heeft een binnenste mesaxon en een buitenste mesaxon die eindigt in een lus of tong van gliacytoplasma (Figuur 4-3). In tegenstelling tot de perifere zenuw, waar de schede wordt omgeven door Schwann-celcytoplasma, is de cytoplasmische tong in het CZS beperkt tot een klein deel van de schede. Deze gliatong is continu met het plasmamembraan van de oligodendrogliale cel via slanke processen. Een gliacel kan 40 of meer afzonderlijke axonen myeliniseren [8].
Myelindepositie in het PNS kan resulteren in een enkel axon met maximaal 100 myelinlagen; het is dus onwaarschijnlijk dat myeline wordt afgezet door een eenvoudige rotatie van de Schwann-celkern rond het axon. In het CZS wordt zo'n postulaat uitgesloten door het feit dat één gliacel meerdere axonen kan myeliniseren. Tijdens myelinisatie zijn er toenames in de lengte van de internode, de diameter van het axon en het aantal myelinelagen. Myeline breidt zich dus uit in alle vlakken tegelijk. Elk mechanisme om deze groei te verklaren, moet aannemen dat het membraansysteem in staat is tot uitzetten en inkrimpen en dat lagen over elkaar heen glijden.
Myeline kan in hoge opbrengst en zuiverheid worden geïsoleerd door conventionele methoden van subcellulaire fractionering
Als het weefsel van het CZS wordt gehomogeniseerd in media met een lage ionische sterkte, schilfert myeline van de axonen af en vormt zich opnieuw in vesikels van de grootteorde van kernen en mitochondriën. Vanwege hun hoge lipidengehalte hebben deze myeline-vesikels de laagste intrinsieke dichtheid van alle membraanfracties van het zenuwstelsel. Procedures voor isolatie van myeline maken gebruik van zowel de grote vesiculaire omvang als de lage dichtheid [9].
In een veelgebruikte methode wordt een homogenaat van zenuwweefsel van knaagdieren, of dissectiewit in het geval van grotere dieren, in isotone sacharose (0,3 M) rechtstreeks aangebracht op 0,85 M sacharose en gecentrifugeerd bij hoge snelheid. Mitochondriën en synaptosomen bezinken door de dichtere sacharose, en veel van de kleinere membraanfragmenten van andere organellen blijven in de 0,3 M sacharoselaag achter. Een ruwe myelinelaag verzamelt zich aan de interface. De belangrijkste onzuiverheden, microsomen en axoplasma gevangen in de vesikels tijdens de homogenisatieprocedure, worden vrijgegeven door de myeline bloot te stellen aan osmotische schok in gedestilleerd water. De grotere myeline-deeltjes kunnen vervolgens worden gescheiden van het kleinere, membraanachtige materiaal door centrifugatie bij lage snelheid of door de dichtheidsgradiëntcentrifugatie te herhalen op continue of discontinu gradiënten, meestal van sacharose. Voorbereidingen van gezuiverde myeline kunnen verder worden onderverdeeld en willekeurig in fracties van verschillende dichtheden door centrifugatie op uitgebreide continue of discontinu dichtheidsgradiënten. Deze fracties verschillen enigszins in samenstelling.
De aantoningsgraad van zuiverheid voor een myelinevoorbereiding omvat de elektronenmicroscopische verschijning; echter maken de moeilijkheid om kleine membraanvesikels van microsomen te identificeren in een veld van myelinemembranen en de bekende bemonsteringsproblemen inherent aan de elektronenmicroscopie deze karakterisering onbetrouwbaar nadat een zeker zuiverheidsniveau is bereikt.
Markeringen die kenmerkend zijn voor myeline omvatten bepaalde eiwitten, lipiden en enzymen zoals beschreven in de volgende secties. Hoewel dergelijke assays nuttig zijn, zijn ze, net als elektronenmicroscopie, niet gevoelig voor kleine hoeveelheden onzuiverheden. Als zuiverheid van een myelinevoorbereiding een probleem is, is het belangrijk om de verontreiniging van myeline door andere subcellulaire fracties te beoordelen met behulp van markers zoals succinaatdehydrogenase voor mitochondriën; Na,K-ATPase en 5′-nucleotidase voor plasmamembranen; NADH-cytochroom-C-reductase voor microsomen; DNA voor kernen; RNA voor kernen, ribosomen en microsomen; lactaatdehydrogenase voor cytosol; β-glucosidase voor lysosomen; en acetylcholinesterase voor neuronale fragmenten. Hoewel al deze markers laag zijn in gezuiverde myeline en een buitenlimiet stellen voor niveaus van verontreiniging door andere membranen, kan de daadwerkelijke verontreiniging minder zijn dan berekend met dergelijke methoden, aangezien lage niveaus van veel verschillende enzymen lijken intrinsiek te zijn aan myeline.
Perifere zenuwmyeline kan worden geïsoleerd met vergelijkbare technieken, maar vooral krachtige homogenisatieomstandigheden zijn vereist vanwege de grote hoeveelheden bindweefsel en soms aanwezig vetweefsel in de zenuw. De iets lagere dichtheid van de PZS-myeline vereist enige aanpassing van de gradiëntensamenstelling om verlies van myeline te voorkomen.